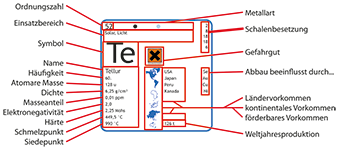
Zink-Chemie » Eigenschaften
Zink ist ein bläulich weißes, unedles Metall, welches bei Zimmertemperatur und oberhalb 200 °C ziemlich spröde ist. Zwischen 100 und 200 °C ist es jedoch recht duktil und lässt sich leicht verformen. Sein Bruch ist silberweiß. Zink kristallisiert in einer hexagonal-dichtesten Kugelpackung. Diese ist allerdings senkrecht zu den Kugelschichten gestreckt, die Abstände zwischen den Zinkatomen unterscheiden sich leicht (in einer Schicht 264,4 pm, zwischen den Schichten 291,2 pm).
An der Luft bildet Zink eine witterungsbeständige Schutzschicht aus Zinkoxid und -carbonat (Zn5(OH)6(CO3)2). Daher verwendet man es trotz seines unedlen Charakters als Korrosionsschutz (Verzinken von Eisen). Zink löst sich in Säuren unter Bildung von Zink(II)-Salzen und in Laugen unter Bildung von Zinkaten, [Zn(OH)4]2−, auf. Eine Ausnahme ist Zink mit sehr hoher Reinheit (99,999 %), welches nicht mit Säuren reagiert. Zink liegt in seinen Verbindungen fast ausnahmslos in der Oxidationsstufe +II vor.
Chemisch zählt Zink zu den unedlen Metallen (Redoxpotential −0,763 Volt). Das kann beispielsweise dafür ausgenutzt werden, edlere Metalle aus ihren Salzen durch Reduktion elementar abzuscheiden, wie hier am Beispiel der Umsetzung eines Kupfersalzes gezeigt wird:
In Pulverform ist Zink ein selbstentzündlicher (pyrophorer) Feststoff. Er kann sich bei Raumtemperatur an der Luft ohne Energiezufuhr erhitzen und schließlich entzünden. Die Zündbereitschaft hängt unter anderem sehr stark von der Korngröße und dem Verteilungsgrad ab. Bei Kontakt mit Wasser bildet Zinkpulver entzündliche Gase, die sich spontan entzünden können.