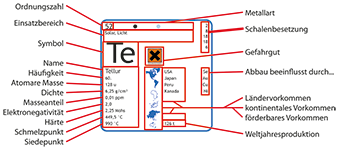
Zink-Chemie
Nachweis
Ein einfacher Zinknachweis beruht auf dem Erhitzen einer Probe mit wenigen Tropfen einer verdünnten Lösung eines Cobaltsalzes auf einer Magnesiarinne im Bunsenbrenner. Ist Zink zugegen, ist nach kurzer Zeit das so genannte Rinmans Grün zu erkennen.
Die quantitative Bestimmung kann mittels Komplexometrie mit einer EDTA-Maßlösung erfolgen. Zur Spurenbestimmung kommen die verschiedenen Methoden der Polarographie in Fr…
» Lesen Sie mehr…

Darstellung
Zink wird überwiegend aus Zinksulfid-Erzen gewonnen. Um diese zu verwenden, müssen sie zunächst in Zinkoxid umgewandelt werden. Das geschieht durch Rösten an der Luft. Dabei entstehen neben dem Zinkoxid große Mengen Schwefeldioxid, die zu Schwefelsäure weiterverarbeitet werden können.
Wird Smithsonit als Rohstoff verwendet, kann dies durch Brennen unter Abspaltung von Kohlenstoffdioxid erfolgen.
Nasse (elektrochemisch…
» Lesen Sie mehr…

Eigenschaften
Zink ist ein bläulich weißes, unedles Metall, welches bei Zimmertemperatur und oberhalb 200 °C ziemlich spröde ist. Zwischen 100 und 200 °C ist es jedoch recht duktil und lässt sich leicht verformen. Sein Bruch ist silberweiß. Zink kristallisiert in einer hexagonal-dichtesten Kugelpackung. Diese ist allerdings senkrecht zu den Kugelschichten gestreckt, die Abstände zwischen den Zinkatomen unterscheiden sich leic…
» Lesen Sie mehr…

Verbindungen
Oxide
Zinkoxid bildet farblose, hexagonale Kristalle. Es wird als Pigment, in Farben, Kautschuk, Fotokopierpapier und Chemikalien verwendet. Weitere Verwendungen finden sich in Bodenbelägen, Gläsern, Emails, Geweben, Kunststoffen, Schmiermitteln, bei der Herstellung von Kunstseide und in Arzneimitteln.
Halogenide
Zinkchlorid ist weiß und stark hygroskopisch. Es wird in…
» Lesen Sie mehr…